業績推移
| 業績の推移(百万円) | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| 売上高 | 営業利益 | % | 経常利益 | % | 当期利益 | % | 一株利益 | 一株配当 | |
| 2013-03-31 | 451 | 0 | 0.0 % | 219 | 48.6 % | 217 | 48.1 % | 18.2 | 0.00 |
| 2014-03-31 | 933 | 0 | 0.0 % | 19 | 2.0 % | 17 | 1.8 % | 1.5 | 0.00 |
| 2015-03-31 | 821 | 0 | 0.0 % | -413 | -- | -412 | -- | -20.6 | 0.00 |
| 2016-03-31 | 822 | -988 | -- | -992 | -- | -994 | -- | -35.3 | 0.00 |
| 2017-03-31 | 529 | -1,113 | -- | -1,116 | -- | -1,113 | -- | -32.7 | 0.00 |
| 2018-03-31 | 354 | -1,561 | -- | -1,573 | -- | -1,577 | -- | -41.3 | 0.00 |
| 2019-03-31 | 155 | -1,665 | -- | -1,678 | -- | -1,884 | -- | -45.0 | 0.00 |
| 2020-03-31 | 11 | -1,827 | -- | -1,823 | -- | -1,857 | -- | -44.2 | 0.00 |
財務
| 財務・CF(百万円) 2020/03/31 | |||
|---|---|---|---|
| 総資産 | 3,474 | 営業CF | -1,784 |
| 純資産 | 3,235 | 投資CF | -106 |
| 自己資本比率 | 91.5 % | 財務CF | 8 |
| 資本金 | 5,433 | 現金等 | 3,018 |
四半期推移表
| 四半期 | 1Q | 2Q | 3Q | 4Q | ||||
|---|---|---|---|---|---|---|---|---|
| 前期 | 今期 | 前期 | 今期 | 前期 | 今期 | 前期 | 今期 | |
| 累計 | 1Q | 1-2Q | 1-3Q | 1-4Q | 会社予想 | ||||
|---|---|---|---|---|---|---|---|---|---|
| 前期 | 今期 | 前期 | 今期 | 前期 | 今期 | 前期 | 今期 | 今期 | |
リンクボタン
トピックス
リスク・対策
2 【事業等のリスク】
当社の事業展開その他に関するリスク要因となる可能性があると考えられる主な事項を以下に記載しております。また、当社として必ずしも重要なリスクと考えていない事項及び具体化する可能性が必ずしも高くないと想定される事項についても、投資判断の上で又は当社の事業活動を理解する上で重要と考えられる事項については、投資家に対する積極的な情報開示の観点から開示しております。当社は、これらのリスク発生の可能性を認識した上で、発生の回避及び発生した場合の対応に努める方針でありますが、それらのすべてについて回避できる保証はありません。また、以下の記載内容は当社のリスクすべてを網羅するものではありませんのでご留意ください。なお、本項記載の将来に関する事項は、当事業年度末現在において当社が判断したものであり、不確実性を内包しているため、実際の結果とは異なる可能性があります。
(1) 創薬事業全般にかかるリスクについて 当社の手掛ける創薬事業では、一つ一つの新規医薬品候補物質の研究開発が、シーズの創製から規制当局の承認を得て医薬品として製造販売に至るまで、薬事規制等に則って探索的研究から第三相臨床試験まで段階を踏みながら進められ、全体として長期間におよぶとともに多額の資金を必要とします。そのため、財務状況への負荷の蓄積をところどころで緩和し、持続可能な成長を実現させるために、当社は医薬品候補物質毎に、シーズの創製や創薬コンセプト証明に集中し、大掛かりな組織体制を必要とする後期臨床試験以降は、製造販売網を有する製薬企業にライセンスアウトして早期収益化を図る事業モデルを採っています。 ライセンスアウトは、開発の段階毎に目標とする試験成績が積み上げられていくことが前提となるので、いずれにせよ研究開発の進捗がライセンスアウトの成否を大きく左右します。そのため、試験成績の目標未達、開発が先行する競合新薬候補が及ぼす影響や、技術革新がもたらす当該技術の陳腐化等により、研究開発が進行遅延若しくは終了・中止を免れない状況になった場合には、ライセンスアウトが成立しなくなる可能性があり、成立した後でも、ライセンス契約解消若しくはロイヤリティ収入の低迷の可能性があります。その場合には、当社の事業、業績や財務状況等に影響を及ぼす可能性があります。
(2) 法的規制等にかかる不確実性について 当社が携わる研究開発領域は、研究開発を実施する国ごとに薬事に係る法律、薬価等が関係する医療保険制度及びその他の関係法規・法令による規制が存在します。当社の事業計画・研究開発計画は、現行の薬事関連法規・法令や規制当局の承認・認可の基準(good laboratory practice、good manufacturing practice、good clinical practice等)を前提に作成しておりますが、これらの法律・法令及び基準は技術の発展・市場の動向などにより適宜改定されます。これにより既存の研究開発の体制(組織的な体制、製造方法、開発手法、臨床試験の進め方、追加試験を行う必要性の発生など)の変更が必要となる場合、その体制の変更に速やかに対処できず研究開発が遅延・中止となるリスク、人員確保や設備投資に計画外の追加資金が必要となり、追加資金確保のために新たな資金調達が必要となるリスクがあり、当社の事業、業績や財務状況等に影響を及ぼす可能性があります。
(3) 競合について 当社が携わる研究開発領域は、急激な市場規模の拡大が見込まれており、欧米を中心にベンチャー企業を含む多くの企業が参入する可能性があります。競合他社の有する医薬品候補物質の研究開発が当社の有する医薬品候補物質と同じ疾患領域で先行した場合又は競合新薬が上市された場合、当社の開発品の競争力が低下する可能性があります。その結果として、当社が進める臨床試験の被験者登録が停滞する等により臨床試験が遅延する可能性若しくは目標被験者数に届かない等により臨床試験が中止となる可能性、導出していた場合はライセンス契約解約の可能性又は上市後に想定したロイヤリティが得られない可能性があり、当社の事業戦略や経営成績等に影響を及ぼす可能性があります。
(4) 研究開発活動について ① 製造物責任のリスクについて 臨床試験実施中に使用する治験薬、大学及びその提携施設が実施する医師主導治験用に提供する治験薬等並びに当社が研究開発した上市後の医薬品に起因して、未知の重篤な健康被害を被験者又は患者に与えた場合、製造物責任を当社が負う可能性又は治験薬等の提供先若しくは導出先の企業から損害賠償の請求を受ける可能性があります。これらの場合には、当社の事業、業績や財務状況等に影響を及ぼす可能性があります。
② 副作用に関するリスクについて 当社が研究開発を実施した治験薬及び上市後の医薬品で、臨床試験段階から製品上市後にかけて、予期せぬ重篤な副作用が発現する可能性があります。重篤な副作用が発現した場合、製造物責任等の損害賠償リスクが発生する可能性がありますが、保険の加入などにより財政的な影響を回避又は最小限にしていくよう対応しておりますが、当社の業績及び財務状況等に影響を及ぼす可能性があります。
③ 研究開発施設等における事故等の発生に関するリスクについて 当社は、本店及び事業所に研究開発施設を有しております。事故防止の管理教育は徹底しておりますが、何らかの原因により火災や環境汚染事故、感染等が発生した場合、研究開発活動の中断、停止、又は、損害賠償や風評被害等重大な損失を招く可能性があります。また、当社は、経営の機動性・効率性の観点、コスト低減や専門性の高い分野における協業などの観点から、研究開発業務の一部を専門機関である外部委託先(cro-医薬品開発業務受託機関、治験実施施設、原薬・製剤の製造業者等)に委託しており、これら外部委託先において何らかの原因により火災や環境汚染事故等が発生した場合にも、当社の事業、業績や財務状況等に影響を及ぼす可能があります。
(5) 知的財産権について ① 特許の状況について 現在出願中の特許については、特許出願時に特許性等に関する調査を行っておりますが、すべてのものが特許として成立するとは限りません。出願中の特許が成立しなかった場合又は登録された特許権が無効化された場合、当社の事業、業績や財務状況等に影響を及ぼす可能性があります。また、特許の出願は、特許の内容、対象国などについて費用対効果を考慮して行いますので、研究開発で得られたすべての特許を出願するものではありません。また、出願費用・維持費用等のコストを回収できない可能性があります。 なお、当社のパイプラインにおいて、その実施に支障又は支障をきたす可能性のある事項は、当社が調査した限りにおいて存在しておりません。
② 知的財産権に関する訴訟及びクレーム等について 本書提出日現在において、当社の事業に関連した特許権等の知的財産権について、第三者との間で訴訟やクレームといった問題が発生した事実はありません。当社は、弁護士及び弁理士との連携を図って可能な限り特許侵害・被侵害の発生リスクを軽減する対策を講じております。 ただし、今後において当社が第三者との間の法的紛争に巻き込まれた場合、弁護士等と協議のうえ、その内容によって個別に対応策を検討していく方針でありますが、解決に時間及び多大の費用を要する可能性があり、場合によっては当社の事業、業績や財務状況等に影響を及ぼす可能性があります。
(6) 研究開発費が多額の見通しであることについて 当社による医薬品候補物質の研究開発の期間は長期間にわたります。また、研究開発の期間においては非常に多くの実証・確認すべき事項があること、また当社では日本国内のみならず海外においても研究開発活動を行っていることなどから研究開発費は多額となる見通しであります。 製薬企業等とのライセンス契約から発生する契約一時金収入、マイルストン収入、ロイヤリティ収入を研究開発中のパイプライン及び新規パイプラインに再投資することを事業及び資金サイクルとしていくこととしておりますが、製薬企業等との契約締結が想定通りに進まない場合又は既存のパイプラインにおいて想定以上の研究開発費が必要となった場合などにおいては、当社の事業、業績や財務状況等に影響を及ぼす可能性があります。
(7) 社内体制について ① 小規模組織であることについて 当社は、役員7名(取締役4名、監査役3名)、従業員は44名(2020年3月31日現在)であり小規模な組織となっており、内部管理体制も規模に応じたものとなっております。人員については、研究開発の状況に応じて増員を図っていく予定であり、内部管理体制も規模に応じて体制の強化を図っていく予定であります。しかし、小規模組織のため、役員はじめ従業員においてもそれぞれが重要な役割を持って業務に従事しており、特定の役員・従業員への過度な負担・依存とならないよう経営組織の強化を図る予定でありますが、退任・退職により人材が流出した場合、長期休養等により長期間業務の遂行が困難となった場合、代替要員を適時に確保できない場合、業務の引継ぎが不十分となった場合などにおいては、当社の事業、業績や財務状況等に影響を及ぼす可能性があります。
② 情報管理について 当社の事業においては、研究開発におけるデータ、ノウハウ、技術など、経理業務における財務データ、人事業務における役員、社員に関する情報などは非常に重要な機密事項になります。また、業務を通して入手した個人情報も重要な機密事項となります。その機密事項の流出リスクを低減するために、機密事項を取り扱う役員、社員に対しては規程等を整備し、情報管理の重要性を周知徹底するとともに、取引先等と守秘義務に関する契約を締結するなど、厳重な情報管理に努めております。 しかしながら、当社の通信インフラの破壊や故障などにより当社が利用しているシステム全般が正常に稼働しない状況に陥ってしまった場合、システムに不具合が発生した場合、又は役員・職員、取引先等により情報管理が十分に遵守されず、重要な機密情報・個人情報などが漏えいした場合には、当社の事業、業績や財務状況等に影響を及ぼす可能性があります。
(8) その他 ① 新株予約権にかかる事項 当社は、優秀な人材を確保するため、また当社の事業及び研究開発活動へのモチベーションの維持・向上を目的として、新株予約権(ストック・オプション)を役員、社員及び社外の協力者等に付与しております。今後においても上記の目的のため新たに新株予約権を付与していく予定であります。また、研究開発領域の拡大に伴い、研究開発費及び事業運営経費が多額に必要となることから新株予約権を活用した資金調達を実施する可能性があります。これらの新株予約権が行使された場合には、1株当たりの株式価値が希薄化する可能性があります。 なお、当社が発行した新株予約権にかかる潜在的株式の数は10,708,600株(2020年5月31日現在)であり、発行済株式総数に対する潜在株式数の割合は25.14%であります。
② 資金使途にかかる事項 2015年10月の株式上場時における公募増資の資金使途につきましては、主にgrn-1201の臨床開発試験、新規パイプライン導入のための研究開発費及び事業運営上必要となる経費等に充当しております。また、2016年5月に開示いたしました第三者割当増資の資金使途につきましては、主にgrn-1201の新規適応症への新規パイプラインに関する臨床開発試験、新規パイプラインの探索・研究開発のための研究開発費、m&a資金及び事業運営上必要となる経費等に充当しております。さらに、2017年11月に開示いたしました第三者割当増資の資金使途につきましては、がん免疫治療領域における研究開発費用及び事業運営上必要となる経費等に充当しております。 しかしながら、今後において事業環境の変化等により、また、上記本項目「事業等のリスク」に記載のリスクの発生により、たとえ計画通りに使用した場合でも、想定している成果を達成できない可能性があります。 なお、当社が携わる研究開発の領域においては、技術開発の変化など外部環境が急速に変化する可能性があります。新薬の上市、法令等の改正、当社の研究開発・臨床試験の進捗状況によっては、上記の資金使途以外の事象に資金を充当する可能性があり、今後の戦略の策定において新たな事象の発生、新たな戦略の実行により、研究開発資金が想定以上に増加する可能性もあります。
③ m&a等(買収、合併等)による事業拡大に関する事項 当社は、事業拡大へ向けた新たな経営資源を取得するため、また保有する経営資源の効率的運用と企業価値を最大化するため、m&a等を活用して事業規模の拡大を図ること検討してまいります。m&a候補の選定に当たりましては、詳細なデューデリジェンスを行うことにより極力リスクを回避してまいりますが、買収後の偶発債務の発生や、のれんが発生する場合は買収後の事業環境や競合状況の変化等により想定通りの効果が得られない場合にのれんの減損損失を計上する等、当社の財政状態及び経営成績に重大な影響が及ぶ可能性があります。
④ 資金調達にかかる事項 当社のパイプラインの研究開発が完了し製品化となるまでまだ長期間を要しますので、今後も多額の資金調達を必要とします。この期間において、事業計画の修正を必要とする状況になった場合、資金不足が生じる可能性があります。その場合、公的補助金の活用や日本国内のみならず海外企業・機関を含めた新規提携契約の締結、新株発行等により資金需要に対応していく予定であります。しかしながら、適切なタイミングで資金調達ができなかった場合には、当社の事業の継続に重大な懸念が生じる可能性があります。 また、今後において、さらなる事業拡大等のための資金調達の方法として新株発行や新株予約権付社債などを発行する可能性があります。新株等発行の結果、1株当たりの株式価値が希薄化する可能性があります。
⑤ 自然災害について 当社は、東京都千代田区及び神奈川県川崎市に事業所及び研究施設を設けております。当社の事業地域で地震等の大規模な災害が発生した場合には、不測の事態の発生により事業活動が停滞する可能性があります。いずれかの地域で大規模な災害が発生した場合でも、いずれかで業務を継続できる体制となっており、また電子データ等のバックアップも前述の各地域以外の場所に設置しております。しかしながら、自然災害の規模、状況によっては、当社及び外部委託先の設備・インフラが支障をきたし稼働できない状況、従業員等が出社できない状況など一時的又は長期間業務が停止し、臨床開発及び事業活動を一時的又は長期間休止せざるを得ない状況が発生した場合には、当社の臨床開発、事業、業績や財務状況等に影響を及ぼす可能性があります。
⑥ 新型コロナウイルス感染拡大の影響 新型コロナウイルス感染拡大に伴い、当社の事業所及び研究施設並びに国内外の臨床試験・非臨床試験・製造委託先及び共同研究開発先社員等の罹患や移動制限・自粛等に伴う要員不足や原材料の納入遅延、並びに製造機能や物流・卸機能の停滞が生じ、結果として研究開発活動に影響を及ぼす可能性があります。また、臨床試験施設においても感染拡大回避のための新規登録の一時中断や来院制限の措置が取られ、現在進行中または新規に立ち上げようとしている臨床試験の遅延等の発生の可能性があります。当社は、リスク情報共有会議を立ち上げ、頻回開催し、当社の国内・海外の製造委託先、共同研究開発のパートナー及び臨床試験施設の状況確認やビジネスにおける影響等について、情報の把握と対応の検討、経営レベルでの議論と意思決定を行っています。
経営指標の推移
(1) 連結経営指標等
回次 | 第13期 | 第14期 | 第15期 | 第16期 | 第17期 | |
決算年月 | 2016年3月 | 2017年3月 | 2018年3月 | 2019年3月 | 2020年3月 | |
売上高 | (千円) | - | 529,612 | 354,410 | - | - |
経常損失(△) | (千円) | - | △1,116,556 | △1,573,292 | - | - |
親会社株主に帰属する当期純損失(△) | (千円) | - | △1,113,661 | △1,577,142 | - | - |
包括利益 | (千円) | - | △1,122,000 | △1,578,417 | - | - |
純資産額 | (千円) | - | 5,201,149 | 6,950,570 | - | - |
総資産額 | (千円) | - | 5,408,300 | 7,235,902 | - | - |
1株当たり純資産額 | (円) | - | 139.17 | 164.78 | - | - |
1株当たり当期純損失金額(△) | (円) | - | △32.74 | △41.25 | - | - |
潜在株式調整後1株当たり当期純利益金額 | (円) | - | - | - | - | - |
自己資本比率 | (%) | - | 95.8 | 95.3 | - | - |
自己資本利益率 | (%) | - | - | - | - | - |
株価収益率 | (倍) | - | - | - | - | - |
営業活動によるキャッシュ・フロー | (千円) | - | △1,067,512 | △1,591,336 | - | - |
投資活動によるキャッシュ・フロー | (千円) | - | △96,564 | △111,556 | - | - |
財務活動によるキャッシュ・フロー | (千円) | - | 3,559,188 | 3,281,082 | - | - |
現金及び現金同等物の期末残高 | (千円) | - | 4,950,570 | 6,528,759 | - | - |
従業員数 | (名) | - | 37 | 42 | - | - |
〔ほか、平均臨時雇用者数〕 | 〔-〕 | 〔4〕 | 〔4〕 | 〔-〕 | 〔-〕 | |
(注) 1.第14期及び第15期は連結財務諸表を作成しているため、第13期については記載しておりません。
2.売上高には、消費税等は含まれておりません。
3.従業員数は就業人員であり、従業員数欄の〔外書〕は、臨時従業員数(派遣社員を含む)の期中平均雇用人員であります。
4.潜在株式調整後1株当たり当期純利益金額については、潜在株式は存在するものの、1株当たり当期純損失金額であるため記載しておりません。
5.自己資本利益率については、親会社株主に帰属する当期純損失を計上しているため記載しておりません。
6.株価収益率については、親会社株主に帰属する当期純損失を計上しているため記載しておりません。
7.第16期より連結財務諸表を作成しておりませんので、第16期以降の連結会計年度に係る主要な経営指標等の推移については記載しておりません。
事業内容 / ビジネスモデル
3 【事業の内容】
当社は、新規の「がん免疫治療薬」の開発に領域を定める、臨床試験段階にあるパイプラインを有する創薬ベンチャーです。事業モデル、技術の特徴は以下のとおりであります。
(1) 事業モデル
当社の事業モデルは、新規がん免疫治療薬を自社創製もしくは導入し、探索研究から早期臨床試験までを手掛け、国内外の製薬会社に開発製造販売権をライセンスアウトし、ライセンス先からライセンス収入を得るものです。
医薬品開発は上市までに一般的に10年以上かかります。よって、開発投資が先行し、後期段階になるほど要する資金が大きくなります。投資を早期に回収する仕組みを作らなければベンチャーで創薬を行うことは難しいですが、現在は承認薬に至ったシードのうち、直近ではベンチャーが創製するシードの数が、従来の大手製薬企業のそれを上回るようになっていることからもわかるように、医薬品産業においては大手製薬企業が開発途上にあるベンチャー創製シーズを導入する仕組みが成立しています。

この事業モデルでは、上市前の開発段階で、ライセンス先製薬企業から開発進捗に応じたライセンス関連収入(ライセンス契約締結時の一時金、その後開発進捗に応じて設定したマイルストンを達成する毎に得られる開発マイルストン収入、上市後は製品売上高の一定割合を得る販売ロイヤリティ収入等)を得ることを目指します。ライセンス後もライセンス先企業と共同開発し、開発費の貢献に合わせて将来の利益を按分したり、ライセンス先から開発協力金を得て開発を主導する等、色々なバリエーションがあります。
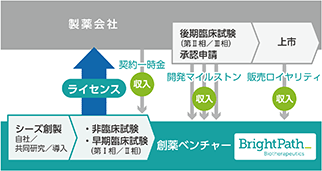
当社は、様々な開発ステージにあるパイプラインの開発を同時並行で進めることにより、投資早期回収と黒字転換後の継続的な収入の実現を図ります。
(2) 開発中のがん免疫治療薬の特徴
当社は「一人ひとりが、自らの力で、がんを克服する世界を実現する」ことを目指し、新規のがん免疫治療薬の開発を行っています。
がん免疫療法は、がん細胞に対する免疫反応(がん免疫)を惹起または増強させ、がん免疫によりがん細胞を殺傷し、腫瘍縮小、がんの進行・転移抑制、再発予防を図るものです。がん治療には約50年に一度生存率を大きく改善する治療法の革新が起こってきましたが、がん免疫治療は、近年において、外科手術・放射線療法・化学療法に次ぐ「第4の治療」としての地位を確立しました。特に、免疫チェックポイント阻害抗体※1は、多様ながん種、がんのステージにおいて標準療法に組み込まれ、がん治療を大きく変えました。一方で、今ある免疫チェックポイント阻害抗体単剤で治療効果が出せる領域にも限りがあることも分かってきており、他の新しいがん免疫治療薬を組み合わせる複合的がん免疫療法や、欧米に続き本邦でも承認されたcar-t(キメラ抗原受容体遺伝子導入t細胞)療法※2に代表される細胞医薬という新しいモダリティ(医薬品形態)も出て来ています。
がん免疫治療薬は、人がもともと備え持つ、がんを排除する免疫システム=がん免疫を適正に「成立」させることによってがんの治療を図るものです。
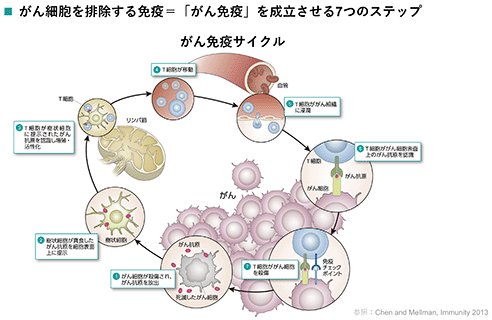
がん免疫の成立を妨げる要因(がん免疫サイクルが滞る箇所)は、がん種、がんのステージ、個人差等によって、異なります。当社はパイプラインにおいて、複数のメカニズム/モダリティを有することによって、その滞りの解消に適した法を選択することを可能にしています。
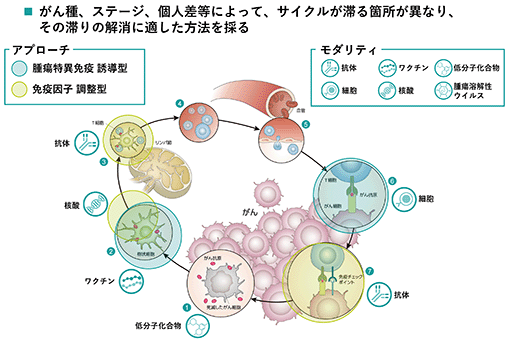
■当社の事業領域
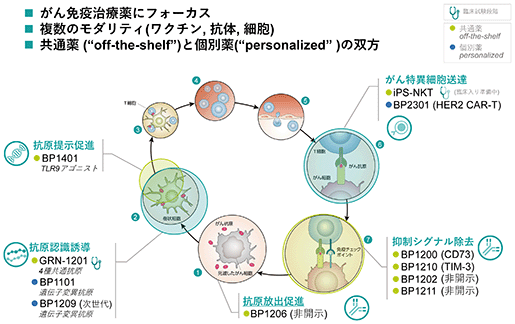
(3) 開発パイプライン
当社が開発を手掛ける新規がん免疫治療薬のモダリティ(医薬品形態)は、がんワクチン、細胞、抗体に及んでいます。4種抗原ペプチド※3で構成されるgrn-1201が最も開発ステージが進んでおり、現在、非小細胞肺がんを対象に本邦初の免疫チェックポイント阻害剤との併用による第ⅱ相臨床試験を米国で進めています。それに、まもなく頭頸部がんを対象とする臨床試験が始まるips細胞由来再生nkt細胞※4療法(導入オプションを取得済み)が続き、その他各種固形がんを対象とする複数の探索・非臨床試験ステージのパイプラインを有します。

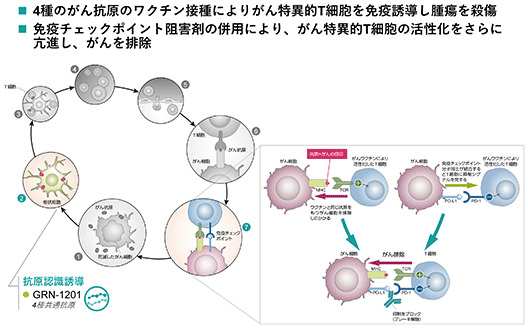
grn-1201(がんペプチドワクチン)・米国でメラノーマ(悪性黒色腫)を対象とする単剤第一相臨床試験及び非小細胞肺がんを対象とした免疫チェックポイント阻害抗体ペンブロリズマブとの併用による第二相臨床試験を実施中 grn-1201は、欧米人が多く有するa2型のhla※5(hla-a2)に結合するペプチド4種で構成される米国や欧州を始めとするグローバル展開を想定したがんペプチドワクチンです。米国でメラノーマ(悪性黒色腫)を対象に第一相臨床試験を実施し、安全性と免疫誘導が示され、現在は同じく米国で非小細胞肺がんを対象に免疫チェックポイント阻害抗体ペンブロリズマブとの併用による第二相臨床試験を実施しています。 がん細胞では、がん細胞特有のペプチドがhlaと結合して表出しており、それを認識する細胞傷害性t細胞(ctl※6)はがん細胞を特異的に直接攻撃します。このため、ctlはがん免疫において最も重要な免疫細胞の一つとされています。grn-1201を構成するペプチドは、このctlに認識される生体内のペプチドと同じアミノ酸配列をもつ化学合成ペプチドであり、このペプチドを投与することにより、これをがんの目印として認識するctlを誘導・活性化し、活性化したctlが生体内で同じペプチドを表出させているがん細胞を攻撃・傷害します。
元来、患者がん細胞由来のcdnaライブラリ(がん細胞内のmrna※7から逆転写酵素※8を用いて合成された相補的dnaのライブラリ)と、がん細胞に特異的に反応する患者t細胞株とを使ってスクリーニングされたもので、非臨床試験と久留米大学における臨床研究を通して、免疫原性と安全性を示唆するデータが得られています。
ペプチドが結合するhlaには型があり、個人差・人種差があります。日本人に最も多いのはhla-a24型で全体の60%を占めますが、欧米ではhla-a2型が最も多く全体の50%を占めており、日本人ではhla-a2型は40%といわれています。grn-1201はグローバルで患者数の多いhla-a2型に結合するペプチドで構成され、欧米での開発を先行させています。
がんペプチドワクチンは、t細胞にがんの目印を与えてがん細胞を排除するよう誘導するものですが、腫瘍局所はそのようなt細胞の機能を抑え込む免疫抑制が働く環境にあります。一方で、現在米国の第二相臨床試験で併用している免疫チェックポイント阻害抗体ペンブロリズマブは、腫瘍局所においてt細胞の活性化を抑制するがん細胞側からの攻撃抑制シグナルをブロックします。すなわち、免疫チェックポイント阻害抗体は腫瘍局所に既に存在するt細胞を活性化する機能を有します。免疫チェックポイント阻害抗体はがん治療に革新をもたらし、様々ながん種で治療効果を示しており、がん種によりますが、単剤での奏効率は10-40%程度と言われております。現在は、治療効果の得られない患者が治療効果を得られるように、既存の化学療法や分子標的薬との併用に加えて、互いの作用メカニズムを補完して免疫サイクル(免疫機構によりがん細胞が認識され殺傷されるまでの一連の流れ)の複数のステップに働きかける作用を持つがん免疫治療薬同士を併用したいわゆる複合的がん免疫療法が盛んに検討されております。当社のがんペプチドワクチンgrn-1201と免疫チェックポイント阻害抗体ペンブロリズマブの併用も、このがん免疫療法の次のテーマである複合的がん免疫療法の一つなることを期待して臨床開発を進めています。
ips-nkt(ips細胞由来再生nkt細胞療法)
・多面的な抗腫瘍効果を有する免疫細胞(直接傷害/自然免疫の活性化/獲得免疫の誘導/免疫抑制環境の改善)
・理化学研究所との導入オプション付共同研究を実施中
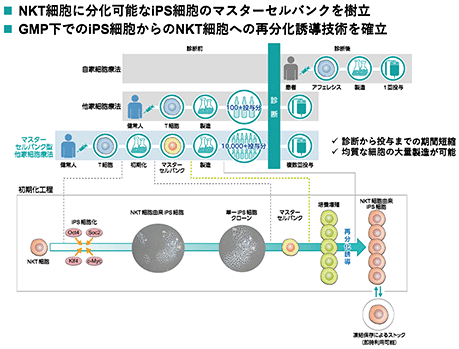
早期の免疫応答に関与しがん細胞を直接殺傷するとともに、自然免疫を増強するのみならず、自然免疫から獲得免疫への橋渡し役も担い、他の免疫細胞を活性化させるアジュバント作用をもちながら、体内には微量(末梢血リンパ球のうち0.1%以下)にしか存在しない免疫細胞であるnkt細胞を、ips細胞の高い増殖性を活かして必要量を確保し、がん免疫治療として用います。
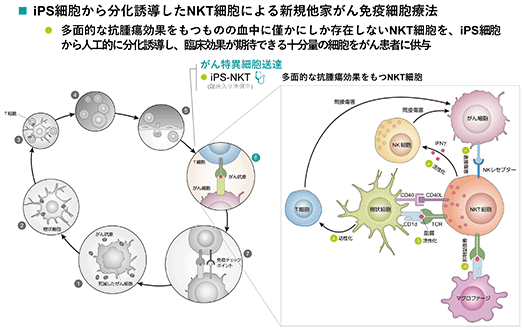
欧米に続き本邦でも昨年承認されたcar-t(キメラ抗原受容体遺伝子導入t細胞)に代表される細胞医薬の次のテーマと言える、血液がん対象から固形がん対象への拡張、ならびにエフェクター細胞の自家(都度特注となり製造原価が高い)から他家(健常人由来で作り置きと診断後即時投与を可能にする)への移行を、ips細胞技術のがん免疫療法に応用することによって実現しようとするものです。
当社は、2018年3月に、国立研究開発法人理化学研究所統合生命医科学研究センターが進める細胞医薬の技術開発と臨床応用に向けたプロジェクトに参画しました。本プロジェクトは、理化学研究所が中心となって日本医療研究開発機構(amed)再生医療実現拠点ネットワークプログラム疾患・組織別実用化研究拠点(拠点b)に採択された「nkt細胞再生によるがん免疫治療技術開発拠点」プロジェクト及び理研創薬・医療技術基盤プログラムのプロジェクトとして進められているもので、頭頸部がんを対象とする医師主導治験を予定しています。当社は、理化学研究所からips-nkt細胞療法の独占的開発製造販売ライセンスのオプション権を取得しており、世界でも初となるips-nkt細胞療法の臨床応用実現にむけ、本医師主導治験を全面的に後押しいたします。
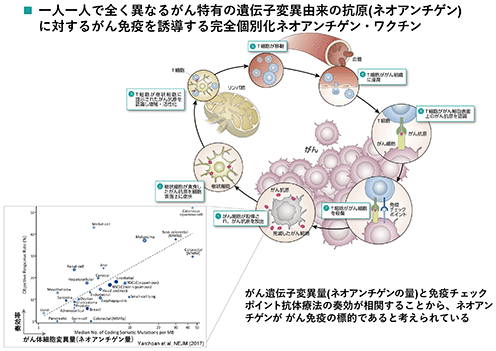
bp1101(ネオアンチゲン※9)
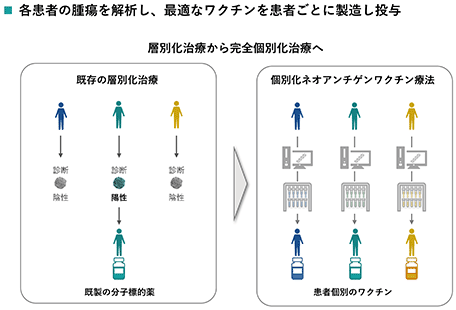
一人一人で全く異なるがん特有の遺伝子変異由来の抗原(ネオアンチゲン)に対するがん免疫を誘導する完全個別化ネオアンチゲンワクチン※10です。
がん遺伝子変異量(ネオアンチゲンの量)と免疫チェックポイント抗体療法の奏効が相関することから、ネオアンチゲンががん免疫の標的であると考えられています。
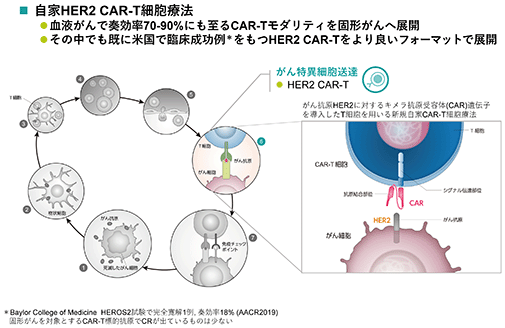
bp2301(her2 car-t)
bp2301は、様々な固形がんで高発現しているher2抗原を認識するキメラ抗原受容体遺伝子導入t細胞(her2 car-t細胞)療法です。
血液がんで優れた臨床効果を示し承認されたcar-t療法は、より多くの患者がいる固形がんへと適応を拡げるにあたって、がん免疫に抑制がかかる腫瘍微小環境において疲弊し十分に機能を発揮できないという課題がありました。この課題を乗り越えるために、当社は中沢教授らと新規car-t細胞培養法を共同開発し、これを中沢教授の非ウイルス遺伝子導入法と組み合わせることにより、疲弊していない若いメモリーフェノタイプのまま体内で長期生存可能なcar-t細胞の製造に成功しました。これにより、car-t細胞移入後の持続的な抗腫瘍効果発現が期待されます。
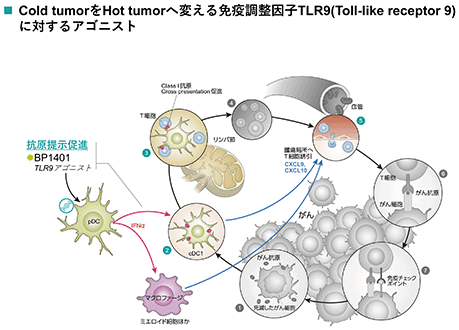
bp1401(tlr9アゴニスト)
bp1401は、抗腫瘍効果を持つt細胞が能動的に賦活化される環境を整えるために樹状細胞の受容体tlr9を刺激するtlr9アゴニストです。bp1401による刺激はサイトカインシグナルを介して、賦活化されたt細胞をはじめとする免疫細胞が腫瘍局所に存在していない、いわゆる“cold tumor”の状態を、それらが多く存在する“hot tumor”へと転換することを図るものです。これにより、抗腫瘍免疫が効果的に働くことが期待されます。
bp1401は、このtlr9アゴニストの有効成分である核酸を脂質に織り込む脂質製剤とすることで安定性を高め、標的とするtlr9発現樹状細胞への核酸のデリバリーを高めています。
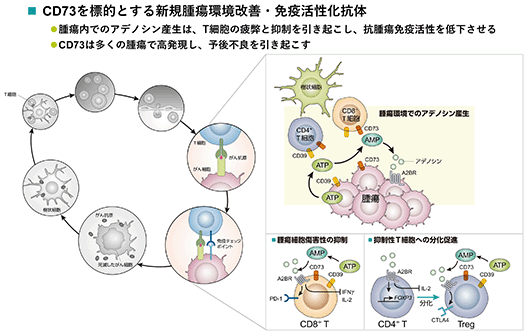
bp1200(抗cd73抗体)
cd73を標的とする新規腫瘍環境改善・免疫活性化抗体です。
腫瘍内でのアデノシン産生は、t細胞の疲弊と抑制を引き起こし、抗腫瘍免疫活性を低下させます。cd73は多くの腫瘍で高発現し、予後不良を引き起こすことも報告されています。bp1200はアデノシン産生酵素の機能を阻害します。
bp1210(抗tim-3抗体)
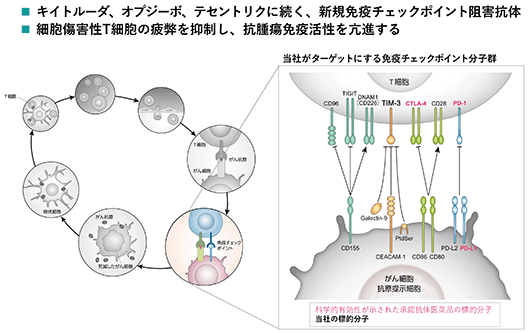
世界各国の多様ながん種、ステージで医薬品承認が進む免疫チェックポイントpd-1/pd-l1阻害抗体に続く、免疫チェックポイントtim-3を阻害する新規抗体です。
bp1210は、細胞傷害性t細胞に発現するtim-3を阻害することにより、tim-3がもたらす細胞疲弊を抑制し、抗腫瘍免疫活性を亢進します。
(4) 許認可、免許及び登録等の状況について
① 許認可、免許及び登録、行政指導等
医薬品開発は、各国の医薬品の開発及び当局への申請等に関する法律、日本では「医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律」(略称:薬機法、2014年11月25日施行、「薬事法」から改称)、米国では「連邦食品・医薬品・化粧品法(federal food, drug, and cosmetic act)及びその関連する法令」、上記の他、日本及び米国を含め各国における当局の省令やガイダンス、ならびに安全性に関する非臨床試験の実施基準(glp;good laboratory practice)、臨床試験の実施基準(gcp;good clinical practice)、製造管理及び品質管理規則(gmp;good manufacturing practice)の下で進めております。
② 知的財産権の状況
知的財産は、個別のペプチドの物質特許を押さえ、その上で複数ペプチド投与を前提とするためその組み合わせの臨床上の有用性を、実際の臨床試験のデータを実施例として特許化する2層構造が骨格となります。なお、grn-1201については、物質特許を含め当社が特許を有しております。
<主要な特許の状況>
発明の名称 | 特許登録番号 | 出願国(登録国) | 権利者 |
上皮細胞増殖因子受容体(egfr)由来ペプチド | 4579836 | 日本 | 当社 |
7655751 | 米国 | ||
2554195 | カナダ | ||
腫瘍抗原 | 7465452 | 米国 | 当社 |
1207199 | 欧州(注) | ||
2381348 | カナダ | ||
4051602 | 日本 | ||
4097178 | 日本 | ||
4035845 | 日本 | ||
4624377 | 日本 | ||
cd4陽性t細胞に認識されるペプチド | 4443202 | 日本 | 当社 |
副甲状腺ホルモン関連タンパク質のhla-a24またはhla-a2結合ペプチド | 4579581 | 日本 | 当社 |
がんペプチドワクチン | 2591799 | 欧州(注) | 当社 |
5706895 | 日本 | ||
5980303 | 日本 |
(注)欧州については、ドイツ、スペイン、フランス、英国、イタリアが含まれております。
[用語解説]
※1(免疫チェックポイント阻害抗体)
がん細胞がもつ、免疫の働きにブレーキをかけて免疫細胞の攻撃から逃れる仕組みを阻止するため、免疫チェックポイントと呼ばれる分子を阻害してブレーキを解除する抗体医薬品を指す。
※2(car-t)
chimeric antigen receptor t-cell therapy:キメラ抗原受容体遺伝子導入t細胞療法
ある特定のがんに対する、キメラ抗原受容体の遺伝子を患者のt細胞という免疫細胞に導入し、その遺伝子導入されたt細胞を体外で増やして患者に戻すという治療法。ヒト白血球抗原(hla)の型に依存せず、多くの患者に適用することができるといった特徴がある。
※3(ペプチド)
アミノ酸が複数個つながったもの。タンパク質の断片。
※4(nkt細胞)
nkt細胞は、がん細胞を直接殺傷する能力をもつと同時に、他の免疫細胞を活性化させるアジュバント作用をもつ免疫細胞のこと。活性化すると、多様なサイトカインといわれる物質を産生し、自然免疫系に属するnk細胞の活性化と樹状細胞の成熟化を促す。成熟した樹状細胞は、更に獲得免疫系に属するctlを増殖・活性化させることで、相乗的に抗腫瘍効果が高まる。また、自然免疫系を同時に活性化させることで、t細胞では殺傷できないmhc陰性のがん細胞に対しても殺傷能を持つ特徴がある。
※5(hla)
hla(human leukocyte antigen=ヒト白血球抗原)は、体のほとんど全ての細胞表面で発現がみられる、免疫機構において重要なタンパク質で、細菌やウイルスなどの病原体の排除やがん細胞の拒絶、臓器移植の際の拒絶反応などに関与しており「主要組織適合遺伝子複合体」とも呼ばれています。
hlaはがん細胞でも細胞表面上に発現しており、がんワクチンの作用機序においては、がん細胞内でがん抗原タンパクが分解されて生成されたペプチドと結合して細胞表面に移動し、ctlにがん細胞として認識させるように機能します。
hlaは自己と非自己(他)を区別する「自他認識のマーカー」であり、非常に多様な「他(た)」を自己と区別するために、非常に多様な型があります。ペプチドはhlaの特定の型に結合し、型が合わない場合は結合しません。
※6(ctl:細胞傷害性t細胞)
ctlはcytotoxic t lymphocyteの略語で、リンパ球のうちのt細胞の一種。細胞表面のt細胞受容体を通じて、樹状細胞等の抗原提示細胞から提示された異物を特異的に認識し、同じくその異物を表面上に提示しているウイルス感染細胞やがん細胞を認識し、細胞傷害物質のサイトカインであるパーフォリンやグランザイムなどを放出することで殺傷することができます。以前はキラーt細胞とも呼ばれていました。
※7(rna)
リボ核酸(ribonucleic acid)の略称。dnaも核酸であるが、dnaは核の中で様々な情報を蓄積・保存をする役割があるのに対し、rnaはその情報の一時的な処理を行うという役割があります。
生体内の働き・構造から、翻訳の鋳型となる伝令rna(メッセンジャーrna, mrna)、リボソームの主要構成成分であり細胞内rnaの最多成分であるリボソームrna(rrna)などに分類されます。
この中でメッセンジャーrnaは、dnaからタンパク質を合成するための塩基配列情報を持ったrnaで、mrnaと表記されます。タンパク質の合成は、dnaからタンパク質を合成するために必要な塩基配列情報をコピーしたmrnaが合成され、このmrnaの塩基配列情報に従ってタンパク質が合成されます。
※8(逆転写酵素)
rna依存性dnaポリメラーゼ (rna-dependent dna polymerase) のこと。逆転写反応を触媒する酵素。この酵素は一本鎖rnaを鋳型としてdnaを合成(逆転写)するもので、レトロウイルスの増殖に必須の因子として発見されました。逆転写酵素は相補的dna(cdna)の合成に利用され(逆転写反応)、遺伝子工学や分子生物学的実験には必須のツールとなっています。
※9(ネオアンチゲン)
がん細胞に独自の遺伝子異常が起きた際に生じる、遺伝子変異(アミノ酸変異)を含む抗原を指します。個々の患者のがん細胞に生じた独自の遺伝子変異によって発現されるようになったがん特異的な抗原で、正常な細胞には存在しません。免疫系から「非自己」として認識されるネオアンチゲンを標的とすることで、がん細胞を殺傷する免疫を効率よく誘導できるようになることが期待されています。
※10(完全個別化ワクチン)
個々の患者のがん細胞にあるネオアンチゲンを探索し、これに対するオーダーメイドのがんワクチン。海外で臨床試験が行われている。
決算(通期)
当事業年度末における流動資産は前事業年度末より1,833,461千円減少し3,328,186千円となりました。これは、現金及び預金が研究開発等に関連する支出により1,882,820千円減少したことが主な要因であります。
② 固定資産
当事業年度末における固定資産は前事業年度末より3,636千円増加し146,452千円となりました。これは、研究機器の購入により工具、器具及び備品が6,395千円増加したことが主な要因であります。
セグメント情報(通期)
(セグメント情報等)
【セグメント情報】
前連結会計年度(自 平成28年4月1日 至 平成29年3月31日)
当社グループの事業セグメントは、医薬品開発事業のみの単一セグメントであり重要性が乏しいため、セグメント情報の記載を省略しております。
当連結会計年度(自 平成29年4月1日 至 平成30年3月31日)
当社グループの事業セグメントは、医薬品開発事業のみの単一セグメントであり重要性が乏しいため、セグメント情報の記載を省略しております。
【関連情報】
前連結会計年度(自 平成28年4月1日 至 平成29年3月31日)
1.製品及びサービスごとの情報
当社グループは、医薬品開発事業の単一セグメントであるため、記載を省略しております。
2.地域ごとの情報
(1) 売上高
本邦以外の外部顧客への売上高がないため、該当事項はありません。
(2) 有形固定資産
本邦以外に所在している有形固定資産の金額がないため、該当事項はありません。
3.主要な顧客ごとの情報
(単位:千円)
顧客の名称又は氏名 | 売上高 | 関連するセグメント名 |
富士フイルム株式会社 | 515,370 | 医薬品開発事業 |
当連結会計年度(自 平成29年4月1日 至 平成30年3月31日)
1.製品及びサービスごとの情報
当社グループは、医薬品開発事業の単一セグメントであるため、記載を省略しております。
2.地域ごとの情報
(1) 売上高
本邦以外の外部顧客への売上高がないため、該当事項はありません。
(2) 有形固定資産
本邦以外に所在している有形固定資産の金額がないため、該当事項はありません。
3.主要な顧客ごとの情報
(単位:千円)
顧客の名称又は氏名 | 売上高 | 関連するセグメント名 |
富士フイルム株式会社 | 318,522 | 医薬品開発事業 |
【報告セグメントごとの固定資産の減損損失に関する情報】
前連結会計年度(自 平成28年4月1日 至 平成29年3月31日)
該当事項はありません。
当連結会計年度(自 平成29年4月1日 至 平成30年3月31日)
該当事項はありません。
【報告セグメントごとののれんの償却額及び未償却残高に関する情報】
前連結会計年度(自 平成28年4月1日 至 平成29年3月31日)
当社グループは、医療品開発事業の単一セグメントであるため、記載を省略しております。
当連結会計年度(自 平成29年4月1日 至 平成30年3月31日)
当社グループは、医療品開発事業の単一セグメントであるため、記載を省略しております。
【報告セグメントごとの負ののれん発生益に関する情報】
前連結会計年度(自 平成28年4月1日 至 平成29年3月31日)
該当事項はありません。
当連結会計年度(自 平成29年4月1日 至 平成30年3月31日)
該当事項はありません。
決算(直近四半期)
2 【経営者による財政状態、経営成績及びキャッシュ・フローの状況の分析】
文中の将来に関する事項は、当四半期会計期間末日現在において、当社が判断したものであります。
(1)経営成績の状況
当第3四半期累計期間において当社は、米国で非小細胞肺がん対象の第二相臨床試験を実施中のがんペプチドワクチンgrn-1201を始めとして、がんワクチン、細胞医薬、抗体医薬をモダリティとする新規がん免疫療法の研究開発を推進いたしました。
①grn-1201(グローバル向けがんペプチドワクチン)
grn-1201は、欧米人に多いhla-a2型のペプチド4種で構成される、米国や欧州を始めとするグローバル展開を想定したがんペプチドワクチンです。より多くの抗腫瘍効果をもつt細胞を誘導できるよう複数抗原をワクチンとして投与するところに特徴があります。米国でメラノーマ(悪性黒色腫)を対象に第一相臨床試験を実施し、安全性と免疫誘導が示され、現在は同じく米国で、非小細胞肺がんの、免疫細胞にダメージを与える化学療法をいくつも経た患者でなく一次治療(ファースト・ライン)の患者を対象に、日本発ワクチンとしては初となる、免疫チェックポイント阻害抗体ペンブロリズマブとの併用による第二相臨床試験を実施しています。これまでのがんワクチンの開発は、ワクチンで誘導された活性化t細胞が、免疫抑制がかかる腫瘍局所に浸潤したとき疲弊してしまう可能性が技術課題として挙げられてきました。そこで、本第二相臨床試験では、ペンブロリズマブをワクチンと併用することで免疫抑制を一部解除し、t細胞が本来の抗腫瘍効果を発揮できるようになることを想定しています。一定の累積症例数に至ったところで、中間評価を行い、目標とする奏効率をクリアしていれば、さらに症例数を積み重ねていきます。
②bp1101(ネオアンチゲン※1ワクチン)
bp1101は、がん特有の遺伝子変異由来の抗原(ネオアンチゲン)に対するがん免疫を誘導する完全個別化ネオアンチゲンワクチンです。がん遺伝子変異量(ネオアンチゲンの量)と免疫チェックポイント抗体療法の奏功が相関することから、同抗体によりネオアンチゲンをがんの目印として認識するt細胞の抗腫瘍効果が高まると考えられています。このネオアンチゲンは患者一人ひとりで全く異なるため、一人ひとりに個別のネオアンチゲンワクチンを製造し投与する完全個別化治療となり、一定の患者層に共通した薬剤を大量製造することを前提とする従来の医薬品とは異なる開発法が求められます。現在、非臨床試験を進めています。
③bp1401(tlr9アゴニスト)
bp1401は、免疫抑制が強くかかる腫瘍微小環境において、抗腫瘍効果を持つt細胞が能動的に賦活化される環境を整えるために、樹状細胞の受容体tlr9を刺激するtlr9アゴニストです。bp1401による刺激はサイトカインシグナルを介して、t細胞が腫瘍局所に浸潤していない“cold tumor”を、それらが多く存在する“hot tumor”へと転換することを図るものです。bp1401は、このtlr9アゴニストの有効成分である核酸を脂質に織り込む脂質製剤とすることで安定性を高め、標的とするtlr9発現樹状細胞へのデリバリーを高めています。現在、非臨床試験を進めています。
④ips-nkt(ips細胞由来再生nkt細胞※2療法)
ips-nktは、ips細胞から再分化誘導したnkt細胞を用い、固形がんを対象とする新規の他家細胞医薬です。nkt細胞は、多面的な抗腫瘍効果を持ちながら、血中に僅かしか存在しないため、従来の培養法では細胞療法として機能を保った細胞を十分量確保できないという課題がありました。そこで、nkt細胞を一旦ips細胞化することによって、培養での高い増殖能を付与し、そこからnkt細胞に再び分化誘導するという技術開発に成功し、これをがん免疫細胞療法に用いることができるようになりました。ips細胞技術は、現在の自家中心の細胞療法に、均質な細胞の大量製造を可能にするマスターセルバンク型の他家細胞療法を可能にし、大手製薬企業の参入が表明されましたが、これらに先行しております。
当社は2018年に、理化学研究所が進める本開発プロジェクトに参画して共同研究を進めており、ips-nktの独占的開発製造販売ライセンスの導入オプション権を有しています。世界でも初となるips細胞由来再生nkt細胞療法の臨床応用実現に向け、2020年6月から千葉大学医学部附属病院による頭頸部がんに対する医師主導治験が開始され、12月に第1症例目の投与が完了しました。当社は本治験を後押しするとともに、医師主導治験に続く企業治験を見据えた製造工程改良を進めています。
⑤bp2301(her2 car-t細胞療法※3)
bp2301は、様々な固形がんで高発現しているher2抗原を認識するキメラ抗原受容体遺伝子導入t細胞(her2 car-t細胞)療法で、固形がん(骨肉腫)を対象として研究開発を進めています。血液がんで70-90%の奏効率に至る等、優れた臨床効果を示し承認されたcar-t療法を、より多くの患者がいる固形がんへと適応を拡げることを目指しています。固形がんへの展開には、がん免疫に抑制がかかる腫瘍微小環境においてcar-t細胞が疲弊し十分に機能を発揮できないという課題があります。この課題を解決するために、当社は信州大学の中沢洋三教授及び京都府立医科大学の柳生茂希助教らと新規car-t細胞培養法を共同開発し、これを中沢教授の非ウイルス遺伝子導入法と組み合わせることにより、若いメモリーフェノタイプの、体内で長期生存可能で、したがって持続的な抗腫瘍効果発現が期待されるcar-t細胞の製造に成功しました。現在、非臨床試験を実施中です。
⑥bp1200(抗cd73抗体)
bp1200は、腫瘍内でのアデノシン産生に介入するcd73を標的とする新規免疫調整因子抗体です。腫瘍内で産生されるアデノシンは、t細胞の疲弊と抑制を引き起こし、抗腫瘍免疫活性を低下させます。cd73は多くのがんで高発現し、予後不良を引き起こすことが報告されています。bp1200はcd73のアデノシン産生酵素の機能を阻害します。
t細胞ががん細胞を殺傷するがん免疫の成立を妨げる様々な要因が腫瘍局所には存在しますが、その要因のトリガーとなる免疫調整因子の代表的なものがpd-1/pd-l1です。ニボルマブやペンブロリズマブといった抗pd-1抗体は、t細胞疲弊を促す免疫チェックポイントpd-1を抗体で阻害することによってがん免疫の成立が可能となることを、科学的に証明されたことが報告されています。抗pd-1抗体はがん治療の革新をもたらしましたが、それでも奏効率はがん種により10-40%であり、残りの抗pd-1抗体で効果が得られない60-90%の患者の「がん免疫」を、pd-1以外の抑制系免疫調整因子の一つであるcd73を阻害することによって成立させようとするのがbp1200です。現在、リード最適化とさらなる機能評価並びにより機能の高い新規クローンの取得を進めています。
⑦bp1210(抗tim-3抗体)
bp1210は、世界各国の多様ながん種、ステージで医薬品承認が進む免疫チェックポイントpd-1/pd-l1阻害抗体に続く、免疫チェックポイントtim-3を阻害する新規抗体です。tim-3はpd-1分子の局在や機能と同様に、t細胞に発現し、腫瘍局所においてt細胞の疲弊を促します。bp1210は、t細胞に発現するtim-3を阻害することにより、tim-3がもたらす細胞疲弊を回避し、抗腫瘍免疫活性を亢進します。抗pd-1抗体で、抑制系免疫チェックポイントの阻害で「がん免疫」が成立することが科学的に証明されたように、同じ抑制系免疫チェックポイントtim-3を阻害することにより、抗pd-1抗体だけでは不十分だった「がん免疫」を成立させることを目指します。現在、リード最適化とさらなる機能評価並びにより機能の高い新規クローンの取得を進めています。
⑧その他の開発プログラム
これらに加え、抗hla-dr抗体及び抗pvr抗体をはじめとした新しい世代のがん免疫を亢進する抗体医薬シーズ等を複数創製し、川崎創薬研究所において研究を進めています。また、国立研究開発法人国立がん研究センターとの間のネオアンチゲンワクチン設計に用いる抗原予測アルゴリズムを新型コロナウイルス感染症(covid-19)のウイルス抗原同定に活用する共同研究があります。
この結果、当第3四半期累計期間におきましては、営業損失は1,290,120千円(前年同四半期の営業損失は1,324,986千円)、経常損失は1,294,368千円(前年同四半期の経常損失は1,323,898千円)、四半期純損失は1,278,191千円(前年同四半期の四半期純損失は1,337,711千円)となりました。
なお、当社は単一事業であり、セグメントは「医薬品開発事業」でありますので、セグメントごとの記載はしておりません。
<語句説明>
※1「ネオアンチゲン」:(neoantigen) がん細胞に独自の遺伝子異常が起きた際に生じる、遺伝子変異(アミノ酸変異)を含む抗原のこと。個々の患者のがん細胞に生じた独自の遺伝子変異によって発現されるようになったがん特異的な抗原で、正常な細胞には存在しない。免疫系から「非自己」として認識されるネオアンチゲンを標的とすることで、がん細胞を殺傷する免疫を効率よく誘導できるようになることが期待されている。
※2「nkt細胞」:(nkt:natural killer t cell) nkt細胞は、がん細胞を直接殺傷する能力をもつと同時に、他の免疫細胞を活性化させるアジュバント作用をもつ免疫細胞。活性化すると、多様なサイトカインを産生し、自然免疫系に属するnk細胞の活性化と樹状細胞の成熟化を促す。成熟した樹状細胞は、更に獲得免疫系に属するキラーt細胞を増殖・活性化させることで、相乗的に抗腫瘍効果が高まる。また、自然免疫系を同時に活性化させることで、t細胞では殺傷できないmhc陰性のがん細胞に対しても殺傷能を持つ。
※3「car-t細胞療法」:(chimeric antigen receptor t cell therapy) キメラ抗原受容体遺伝子導入t細胞療法。ある特定のがんに対する、キメラ抗原受容体の遺伝子を患者のt細胞という免疫細胞に導入し、その遺伝子導入されたt細胞を体外で増やして患者に戻すという治療法。ヒト白血球抗原(hla)の型に依存せず、多くの患者に適用することができるといった特徴がある。
(2)財政状態の状況
(資産)
当第3四半期累計期間末における総資産は前事業年度末より498,357千円増加し、3,972,996千円となりました。これは、研究開発等に関連する支出の一方で資金調達の実施により現金及び預金が490,695千円増加したことが主な要因であります。
(負債)
当第3四半期累計期間末における負債は前事業年度末より54,263千円減少し、185,137千円となりました。これは、流動負債その他に含まれる未払金が25,014千円減少したこと及び未払法人税等が20,466千円減少したことが主な要因であります。
(純資産)
当第3四半期累計期間末における純資産は前事業年度末より552,620千円増加し、3,787,858千円となりました。これは、資金調達において新株式を発行したことにより資本金及び資本剰余金がそれぞれ929,140千円増加したこと及び四半期純損失1,278,191千円を計上したことが主な要因であります。
以上の結果、自己資本比率は前事業年度末の91.5%から94.6%となりました。
(3)優先的に対処すべき事業上及び財務上の課題
当第3四半期累計期間において、重要な変更及び新たに生じた課題はありません。
(4)研究開発活動
当第3四半期累計期間における研究開発費の総額は、1,047,369千円であります。
なお、当第3四半期累計期間において、当社の研究開発活動の状況に重要な変更はありません。
経営方針
当社は、「私たちは、がん免疫治療分野の最先端を切り拓くことにより、一人ひとりが自らの力でがんを克服する世界を実現します。」を経営理念として、新規がん免疫治療薬を創製することによって、現在進行しているがん治療革新の一翼を担いたいと考えております。
これを実現するために、当社は①開発領域をがん免疫治療薬に特化し、②シーズ導入・創製において国内外のアカデミアやベンチャー企業と広く連携するオープンイノベーションを進めながら、③ライセンスアウト型事業モデルによる好循環で持続可能な開発および企業成長を目指してまいります。
① がん免疫治療薬にフォーカスするのは、がん免疫に働きかけてがんを排除するという創薬コンセプトの有効性が免疫チェックポイント阻害抗体によって証明されており、この創薬コンセプトを具現化する方法を拡げることによって、従来の治療法では治療効果を得られなかったアンメットメディカルニーズを満たすことができるフロンティアが依然として大きく存在するからです。それは、当社が創業以来取り組んで来た経験とノウハウの蓄積がある領域であり、世界の医薬品市場の成長を他のどの医薬品カテゴリーよりも牽引している領域でもあります。
② オープンイノベーションを進めるのは、今や日進月歩でサイエンスが更新されていくがん免疫療法の領域において、最先端のサイエンスへのアクセスを可能にするためです。がん免疫治療のフロンティアには、アンメットメディカルニーズを満たすためのサイエンスがまだ数多く存在しています。創薬ベンチャーとして創薬を好循環で進めるために、当社は③のライセンスアウト型の事業モデルを採っています。知的財産を導出することによって収益化を図るモデルで、その知的財産は、最先端のサイエンスが織り込まれていないと成立しません。
③ ライセンスアウト型の事業モデル(シーズの創製や創薬コンセプト証明に集中し、大掛かりな組織体制を必要とする後期臨床試験以降は、製造販売網を有する製薬企業にライセンスアウトして早期収益化を図る事業モデル)を採るのは、創薬ベンチャーとして開発を持続して行えるようにするためです。一つひとつの新規医薬品候補物質の研究開発は、シーズの創製から規制当局の承認を得て医薬品として製造販売に至るまで、薬事規制等に則って探索的研究から第三相臨床試験まで段階を踏みながら進められ、全体として長期間におよぶとともに多額の資金を必要とします。よって、財務負担が蓄積し経営の機動性を喪失する前に、早期収益化を図ります。
戦略
当社では、ライセンスアウト時の契約一時金と、その後の継続的なマイルストン報酬(マイルストン収入、販売ロイヤリティなど)を収益とするビジネスモデルを採っているため、製薬企業へのライセンスアウト(タイミングとライセンス取引額)、原則としてライセンスアウト成立の前提となる、創薬コンセプトを証明する非臨床試験または臨床試験成績の取得、そこに至るまでの開発イベント(例えば、当局による治験開始申請の受理)が、重要な経営イベントとなります。
持続可能な企業成長と企業価値の向上を目指して、また技術革新著しいがん免疫治療薬分野における事業機会を逃さないために、開発ポートフォリオの継続的な更新を重視しており、既存のパイプラインの開発推進や新規パイプラインの自社創製のみならず、新規パイプラインの導入やオープンイノベーションに基づく共同創出も積極的に進めてまいります。
なお、研究開発型の創薬ベンチャーは、研究開発投資からライセンスアウトによる収益化までの長期間に及ぶ事業サイクルが、開発パイプライン複数個によって資産(企業価値を構成するソフトな資産)構成されるため、売上高や当期純損益や、roe、roaといった年単位で見る指標は、適切な経営指標となりにくいと考えております。
課題
今後もライセンスアウトの動向及び財務状況を鑑みながら研究開発を積極的に推進又は新規投資・導入を行い、企業価値の向上を図っていくために、研究開発活動の質及びその研究開発活動を支える企業活動の基盤としての経営の質を向上させる必要があると認識しております。当社が対処すべき事項として認識している事項は、以下のとおりです。
① 競争力のあるパイプラインのポートフォリオ構築
当社は創業以来がんペプチドワクチンを中心にパイプラインを構成してきましたが、近年がん治療の新時代を築き、当社が開発領域として焦点を定めているがん免疫治療薬の形態(モダリティ)も多様化へ向かい、治療効果が証明され後続が列をなす抗体(免疫チェックポイント阻害抗体)や細胞(car-t)では承認薬も出て、16年前の創業時から様変わりしております。 当社も、免疫調整因子抗体と細胞医薬を開発領域に加えており、さらにがんペプチドワクチン自体も、多数のがん患者に共有される共通抗原(がんの目印)を標的とするitk-1から、共通抗原と免疫チェックポイント阻害抗体を組み合わせる複合的がん免疫療法を志向するgrn-1201へ、さらに、患者ごとにほぼ完全に異なる遺伝子変異抗原を標的として個別にジャスト・イン・タイム製造するネオアンチゲンワクチンへと展開しております。 当社は現時点では新薬候補を後期臨床試験に至る前に製薬企業にライセンスアウトする事業モデルを採っており、ライセンスを成功させるためには当該新薬候補がその時点でサイエンスの面で陳腐化していてはならず、さらにがん免疫療法は全医薬品業界の成長を牽引する領域であるからこそ日進月歩でサイエンスが進んでいるため、当社は常に同分野全体のサイエンスが向かう方向性と進捗を見ながら、各パイプラインの開発ステージを探索から非臨床試験、そして臨床試験へと一定期間内に上げて行くとともに、必要に応じてパイプラインの入れ替えを図っていく必要があります。
② 最先端のサイエンスへのアクセスを可能とする研究開発体制の構築
当社が関わるがん免疫療法は、医薬品業界の成長を牽引するとともにサイエンスが日進月歩で進展する領域であるため、社内に専門性の高い研究員と充実した研究施設を有することが不可欠で、現在も研究施設として川崎創薬研究所を構えておりますが、常にこれを向上させていく必要があります。 さらに、研究開発体制を社内に留めることなく社外にもオープンイノベーションの機会を積極的に求めて行くことが、この領域の最先端のサイエンスの情報収集のみならずパイプラインの充実と迅速なアップデートのためにも不可欠で、現在も国立がん研究センター、東京大学、三重大学、神奈川県立がんセンター、理化学研究所など本邦を代表する研究機関との共同研究を進めております。アカデミアの研究シーズを企業シーズへと迅速かつ着実にトランスレーションする組織能力をより一層高める必要があります。
③ 経営体制の強化
(ⅰ)人材の確保と育成
他の創薬ベンチャーと同様に当社も新規性のある医薬品の開発を行っておりますので、個々の社員には非常に高度な専門性が要求されます。そのため、適切な人材の確保が重要な課題となります。十分な技術・知識のみならずベンチャーマインドを有し、成長意欲のある人材を全部門において採用し、ojtによる人材育成により、今後拡大・加速していくことが予想される事業・研究開発スピードに対応してまいりたいと考えております。
(ⅱ)コーポレート・ガバナンスの強化
当社にとって前述のアライアンス・ネットワーク体制の構築は重要な課題であり、また株主を含めたステークホルダーとの良好な関係も重要な課題であります。社外関係者との良好な関係の構築のためには、社会的信用を維持・向上させていく必要があると認識しております。特に、当社の取引先は主に上場企業、医療機関、公的な研究機関でありますので、協業体制を構築し、取引関係を維持していくには、当社も社会的信用を維持していく必要があります。また、世間に広く製品を提供していく創薬企業としての社会的責任を果たしていく必要があると認識しております。
そのため、当社は小規模ではありますが、コーポレート・ガバナンス体制を構築し、内部管理体制及び管理部門の強化を推進してまいります。また、内部監査の充実及び監査役との連携強化などの施策により業務執行の適法性・妥当性を監視する機能を強化し、財務報告に係るリスクを最小化して、経営の健全化に努めてまいります。
(ⅲ)資金調達・財務基盤の強化
当社は創薬ベンチャーであり、実際の製品化までの研究開発活動において年単位での時間を要します。製品化までの研究開発活動において設備投資、人材の採用・育成、また、企業価値向上のための新規パイプラインの創製(最新の技術の探索、導入及び共同研究など)に多額の資金が必要となります。これらの資金を外部から調達する必要があり、中長期的な視点から、財務基盤の強化のためにも、様々な資金調達の可能性を検討してまいります。
④ ir活動の推進
当社は、株主・投資家等のステークホルダーからの意見を収集し、経営のさらなる改善に努め、また、企業情報及び研究開発の状況等を正確、適時及び適切に発信し、信頼と正当な評価を得ていくことを目指します。
沿革
2 【沿革】
当社は、がん治療における手術・放射線療法・化学療法に次ぐ「第4の治療法」として、アンメット・メディカル・ニーズ(未だに有効な治療方法がない医療ニーズ)を満たす新規がん治療薬となりうる「がん免疫治療薬」の開発を行っております。当社の事業は、学校法人久留米大学 医学部の伊東恭悟教授(現 久留米大学がんワクチンセンター長)らが1992年から先駆的に実施したがんペプチドワクチンの基礎研究及び臨床研究の成果を、2003年の設立とともに承継したところから出発しました。
2016年8月には、本格的な自社創製シーズの開発と、他研究機関との共同研究の拠点として、川崎市殿町のライフイノベーションセンター内に川崎創薬研究所を設置し、免疫調整因子を標的とする抗体医薬の分野に研究領域を拡大しており、さらに、2016年10月以降は、細胞医薬の分野にも研究領域を拡げて、パイプラインの拡充・新薬の開発を進めております。
2017年7月には、がん免疫治療薬分野における最先端のサイエンスを追及し研究領域を拡大・推進していく意思として、会社名を「ブライトパス・バイオ株式会社」に変更いたしました。
年 月 | 変遷の内容 |
2003年5月 | 福岡県久留米市旭町67番地に当社設立(資本金10,000千円) |
2006年1月 | itk-1の去勢抵抗性前立腺がんに対する第一相臨床試験を開始 |
2008年11月 | 本社を福岡県久留米市百年公園1番1号に移転 |
2009年6月 | 東京支社を東京都文京区本郷に設置 |
2009年7月 | itk-1の膠芽腫及び去勢抵抗性前立腺がんに対する第一相臨床試験継続投与試験が完了 |
2011年11月 | 富士フイルム株式会社とitk-1に関する独占的ライセンス契約を締結 |
2013年6月 | itk-1の去勢抵抗性前立腺がん患者に対する第三相臨床試験を開始 |
2014年10月 | 東京支社を東京都千代田区麹町に移転 |
2015年6月 | itk-1の去勢抵抗性前立腺がん患者に対する第三相臨床試験の中間解析の結果、最終解析における主要評価項目達成の見込みが一定以上あることが示され、効果安全性評価委員会が計画通りの試験継続を推奨 |
2015年10月 | grn-1201のメラノーマ(悪性黒色腫)患者に対する第一相臨床試験を開始 |
| 東京証券取引所マザーズ市場に株式を上場 |
2016年8月 | 神奈川県川崎市殿町地区に川崎創薬研究所を開所 |
2017年1月 | grn-1201の免疫チェックポイント阻害剤との併用による非小細胞肺がんに対する米国での第二相臨床試験を開始 |
2017年7月 | 会社名をブライトパス・バイオ株式会社(brightpath biotherapeutics co., ltd.)に変更 |
2018年5月 | itk-1の去勢抵抗性前立腺がん患者に対する第三相臨床試験の開鍵(キーオープン)を実施 |
2019年5月 | itk-1の開発を中止 |
2019年6月 | 本店を神奈川県川崎市川崎区殿町三丁目25番22号に移転 |
配当政策
3 【配当政策】
当社は設立以来配当を実施しておらず、現時点においても配当可能な状況にありません。また、今後も多額の先行投資を行う研究開発活動を計画的に実施していくため、当面は内部留保に努め、研究開発資金の確保を優先する方針です。内部留保資金については、研究開発資金に充当していく予定であります。
ただし、株主への利益還元も重要な経営課題の一つと認識しております。今後の経営成績及び財政状況を勘案しながら早期に配当を実現すべく検討してまいります。
剰余金の配当を行う場合は、年1回期末での配当を考えており、配当の決定機関は株主総会であります。なお、当社は、機動的な配当対応を行うため、会社法第454条第5項に基づく中間配当を取締役会の決議によって行うことができる旨を定款に定めております。
株式の状況
② 【発行済株式】
種類 | 事業年度末現在発行数(株)(2020年3月31日) | 提出日現在発行数(株)(2020年6月29日) | 上場金融商品取引所名又は登録認可金融商品取引業協会名 | 内容 |
普通株式 | 42,101,000 | 42,590,500 | 東京証券取引所(マザーズ) | 完全議決権株式であり、株主としての権利内容に何ら限定の無い当社における標準となる株式であります。なお、単元株式数は100株であります。 |
計 | 42,101,000 | 42,590,500 | ― | ― |
(注) 提出日現在の発行数には、2020年6月1日からこの有価証券報告書提出までの新株予約権の行使により発行された株式数は含んでおりません。
(5) 【所有者別状況】
2020年3月31日現在
区分 | 株式の状況(1単元の株式数100株) | 単元未満株式の状況(株) | |||||||
政府及び地方公共団体 | 金融機関 | 金融商品取引業者 | その他の法人 | 外国法人等 | 個人その他 | 計 | |||
個人以外 | 個人 | ||||||||
株主数(人) | - | 5 | 27 | 127 | 25 | 36 | 24,406 | 24,626 | - |
所有株式数(単元) | - | 6,274 | 22,540 | 20,492 | 4,774 | 361 | 366,518 | 420,959 | 5,100 |
所有株式数の割合(%) | - | 1.49 | 5.35 | 4.87 | 1.13 | 0.09 | 87.07 | 100.00 | - |
(6) 【大株主の状況】
2020年3月31日現在
氏名又は名称 | 住所 | 所有株式数(株) | 発行済株式(自己株式を除く。)の総数に対する所有株式数の割合(%) |
楽天証券株式会社 | 東京都世田谷区玉川1丁目14番1号 | 500,500 | 1.18 |
上田八木短資株式会社 | 大阪府大阪市中央区高麗橋2丁目4-2 | 500,000 | 1.18 |
株式会社sbi証券 | 東京都港区六本木1丁目6番1号 | 459,500 | 1.09 |
三菱ufjキャピタル株式会社 | 東京都中央区日本橋2丁目3-4 | 450,000 | 1.06 |
野村信託銀行株式会社(信託口) | 東京都千代田区大手町2丁目2-2 | 407,200 | 0.96 |
明尾 寛 | 大阪府枚方市 | 300,000 | 0.71 |
株式会社滋慶 | 大阪府大阪市中央区島之内1丁目10番15号 | 270,000 | 0.64 |
大和証券株式会社 | 東京都千代田区丸の内1丁目9番1号 | 245,100 | 0.58 |
永井 健一 | 東京都目黒区 | 240,000 | 0.57 |
auカブコム証券株式会社 | 東京都千代田区大手町1丁目3番2号 | 238,700 | 0.56 |
計 | ― | 3,611,000 | 8.57 |